I artikeln om atomer har du lärt dig om hur i stort sett all materia byggs upp av atomer. Men vanligtvis är det inte fria atomer som bygger upp materien utan grupper av atomer som kallas för molekyler.
Varje molekyl innehåller minst två atomer (men kan innehålla upp till flera miljarder stycken). Och eftersom varje atom är så försvinnande liten, är molekyler vanligtvis också väldigt små. Det går alltså sällan urskilja enskilda molekyler i ett ämne utan kraftiga elektronmikroskop.

Låt oss titta på några exempel på ämnen som byggs upp av molekyler. Ett mycket enkelt sådant ämne är vätgas som förr användes i luftskepp eftersom det är en väldigt lätt gas (detta slutade man dock med eftersom det visade sig att gasen också är mycket explosiv). Vätgasmolekylerna består av väteatomer som sitter ihop två och två.
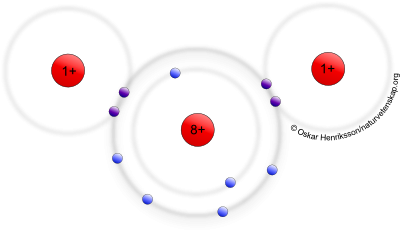
Ett annat exempel är vatten, som består av vattenmolekyler. Varje sådan molekyl innehåller en syreatom och två väteatomer som sitter ihop i en Musse Pigg-liknande formation.
Även etanol som står för alkoholhaltiga dryckers berusande (och giftiga) verkan består av molekyler. Varje etanolmolekyl består av två kolatomer, sex väteatomer och en syreatom.
Som vi nämnde innan finns det också riktigt stora molekyler. Ett exempel är de DNA-molekyler som finns inne i våra celler och som bär på våra arvsanlag. De innehåller flera miljarder atomer av atomslagen kol, syre, väte, kväve och fosfor (det exakta antalet kan dock variera från molekyl till molekyl).
I figuren längst upp visas modeller av dessa fyra ämnens molekyler.
Lite om molekylbindning (överkurs)
Det som håller ihop en molekyl är en slags kemisk bindning som kallas för molekylbindning (ett annat namn är kovalent bindning). Den fungerar genom att atomerna som ingår i molekylen delar på ett eller flera elektronpar (ett elektronpar är det samma som två elektroner). Ett sådant gemensamt elektronpar kallas för bindning och visas med ett streck mellan atomerna i en strukturformel.
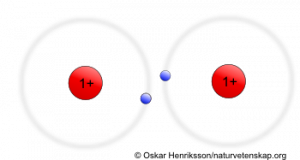
Anledningen till att molekylbindningen uppstår är att naturen strävar efter att ge atomerna ädelgasskal (repetera gärna detta i artikeln om elektroner). Ser vi exempelvis till väteatomerna som ingår i vätgas vill dessa ha två elektroner i sitt K-skal för att likna ädelgasen helium. Detta tillstånd lyckas de komma nära genom att låta sina totalt två elektroner befinna sig runt båda atomernas kärnor. Då kan man se det som att båda väteatomerna tycker sig ha två elektroner i sitt K-skal. Detta illustreras i bilden nedan.
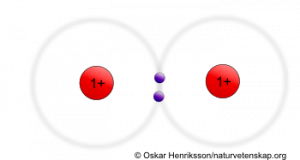
I det här youtube-klippet visas på ett mer verklighetstroget sätt vad som händer med de två elektronerna när två väteatomer bildar en vätgasmolekyl. I slutet av filmen visas hur syreatomer respektive kväveatomer också kan slås ihop. Detta sker genom att de delar på två respektive tre elektronpar. Då uppstår bindningar som kallas dubbel- respektive trippelbindningar. Oftast är sådana lite starkare än vanliga enkelbindingar, där atomerna bara delar på ett elektronpar.
Bilden här nedanför är en modell av en vattenmolekyl och visar hur syreatomen delar på ett elektronpar med vardera väteatom. På så vis får väteatomerna två elektroner i sitt K-skal (och liknar helium), samtidigt som syreatomen får åtta elektroner i sitt L-skal (och liknar neon). Alla atomer kan alltså sägas ha fått ädelgasskal.